EFEK INDUKSI
Efek induksi adalah suatu aksi
elektrostatik yang diteruskan melalui rantai atom dalam suatu molekul. Efek
induksi dapat pula disebut sebagai pengaruh distribusi elektron pada ikatan
sigma. Efek induksi tersebut dapat dinyatakan sebagai I+ dan I-. Apabila I+
jika substituen yang terikat mendorong elektron (melepaskan e-) dan dinyatakan I-
jika substituen yang terikat menarik elektron (mengambil e-). Efek induksi pada
suatu molekul pada berbagai gugus yang bekerja melalui ikatan kimia yang
terdapat pada proton, yang umumnya disebabkan oleh adanya atom-atom yang bersifat
elektronegatif, seperti O, N, Cl. Proton atau inti atom yang makin dekat dengan
atom elektronegatif elektron yang mengelilingi proton tersebut menjadi kurang
rapat.
Efek induksi bekerja pada ikatan
sigma, dimana adanya dorongan dari gugus R membuat kerapatan elektron pada H
semakin tinggi sehingga sulit untuk terionisasi. pengaruh efek induksi
terhadap kekuatan tiga jenis asam karboksilat yang di sintesis dari amida
terletak pada kecenderungan mudahnya lepas gugus hidroksil dalam air yang di
pengaruhi oleh efek induksi tersebut. Pada ikatan kovalen tunggal dari atom
yang tak sejenis, pasangan elektron yang membentuk ikatan sigma, tidak pernah
terbagi secara merata di antara kedua atom. Elektron memiliki kecenderungan
untuk tertarik sedikit ataupun banyak kearah atom yang lebih elektronegatif
dari keduanya. Misalnya dalam suatu alkil klorida, kerapatan elektron akan cenderung
lebih besar pada daerah didekat atom Cl daripada atom C. Jika atom karbon
terikat pada klorin sementara itu klorin
berikatan pada atom karbon selanjutnya, efek induksi dapat diteruskan pada
karbon tetangganya. Namun, efek ini dapat hilang pada suatu ikatan jenuh
(ikatan rangkap). Contoh gugus dan atom yang memiliki efek + I:
Berdasarkan struktur molekul tersebut,
asam metanoat lebih asam dari asam etanoat karena pada asam etanoat terdapat
gugus metil yang mempunyai kemampuan mendorong elektron ikatan melalui ikatan
sigma (C-C-O-H) sehingga atom O menjadi relatif makin negatif, akibatnya atom H
sukar lepas sebagai H+, asamnya menjadi lebih lemah. Gugus CH3
mempunyai efek induksi mendorong elektron, diberi simbol +I.
Asam
alfamonoflouroetanoat lebih asam dari asam metanoat terdapat gugus F yang
mempunyai kemampuan menarik elektron ikatan sigma sehigga atom O menjadi
relatif makin positif, akibatnya atom H makin mudah lepas sebagai H+, asamnya
menjadi lebih kuat. Gugus F mempunyai efek induksi mendorong elektron, diberi
simbol -I.
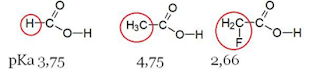
Pengaruh efek induksi terhadap
kekuatan tiga jenis asam karboksilat dari suatu amida, dapat dinyatakan seperti
pada gambar berikut :
Hal tersebut dapat kita ketahui dari
nilai pka yaitu pada asam format memiliki nilai pka 3,68. Nilai pka asam asetat
4,74 dan nilai pka asam butanoat 4,80. Dan semakin kecil nilai pka maka semakin
kuat sifat asamnya , dimana hal ini dipengaruhi karena pada gugus alkil untuk
mendorongsehingga kerapatan H meningkat dan sulit untuk terionisasi. Dan dari
reaksi diatas gugus hidroksil pada asam format sangat sukar untuk terionisasi
dan keasamanya lebih tinggi ,begitu juga dengan gugus hidroksil pada asam
asetat sukar terionisasi dan nilai keasamanya dibawah asam format , begitu juga
untuk asam butanoat yang memiliki gugus hidroksil yang dapat terionisasi dan
nilai keasamanyapun lebih rendah.
Pada etana ikatan C-C adalah non
polar sempurna karena ikatan tersebut menghubungkan dua atom yang ekuivalen.
Akan tetapi ikatan C-C dalam kloroetana terpolarisasi oleh adanya atom klor
elektronegatif. Polarisasi ini sebenarnya adalah jumlah dari dua efek. Efek ini
tidak hanya dirasakan oleh ikatan tetangga, namun dapat pula berpengaruh sampai
ikatan yang lebih jauh. Efek ini berkurang dengan bertambahnya jarak.
Polarisasi ikatan C-C menyebabkan pula sedikit polarisasi tiga ikatan C-H
metil. Di dalam keadaan dasar (ground state) efek-efek ini bekerja secara
permanen dan dapat nyata dalam sejumlah sifat-sifat molekul.
Gugus fungsi dapat dikelompokkan
sebagai gugus penarik elektron (-I) dan gugus pendorong elektron (+I) relatif
terhadap atom hidrogen. Sebagai contoh gugus nitro adalah suatu gugus –I, gugus
ini lebih kuat menarik elektron ke dirinya daripada atom hidrogen. Jadi di
dalam α-nitrotoluena, elektron di dalam ikatan C-N lebih jauh dari atom karbon
daripada elektron di dalam ikatan H-C toluena. Gugus
yang bersifat pendorong elektron hanya gugus dengan muatan formal negatif
(tidak semuanya demikian), atom-atom dengan elektronegatif rendah seperti Si,
Mg, dan sebagainya, dan kemungkinan juga gugus alkil. Gugus alkil biasanya
dipandang sebagai gugus pendorong elektron, tapi akhir-akhir ini sejumlah
contoh yang ditemukan mengarah pada kesimpulan bahwa gugus bersifat penarik
elektron dibanding dengan hidrogen.
Apabila ada gugus yang terkait pada
alkil dari asam karboksilat bersifat menarik elektron, maka efek induktif akan
diteruskan kesemua atom, oksigen dari hidroksida pada asam menjadi relatif
lebih positif, hidrogen mudah lepas kesamaan karboksilat bertambah. Bila
ada gugus yang terikat pada alkil dari asam karboksilat bersifat mendorong
elektron, maka efek induktif akan diteruskan kesemua atom, oksogen dari
hidroksida pada asam menjadi relatif lebih negatif, hidrogen sukar lepas
keasmaan karboksilat berkurang. Tingkat keasaman dan kebasaan suatu
molekul dipengaruhi oleh pka, dimana jika pka kecil berarti asam kuat dan sebaliknya.
Keasaman lebih besar berarti kebasaan lebih kecil dan sebaliknya. Efek Induksi
(E elektrostatik) akan berkurang dengan adanya jarak gugus induksi dengan pusat
reaksi (COOH).
Berikut
ini urutan reaktifitas induksi –I (penarik elektron) adalah sebagai
berikut:
-Cl > -Br > -I > -OCH3 > -OH > -C6H5 >
-CH+CH2 > -H
Sumber :
Firdaus. 2009. Modul Kimia Organik Fisis I. Makassar: Unhas Press.
Firdaus. 2009. Modul Kimia Organik Fisis I. Makassar: Unhas Press.